
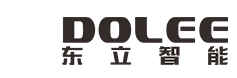

我们平时用到的正置显微镜和倒置显微镜,统称为复合式显微镜,可以用来观察涂片或切片、培养的活细胞、水中的微生物或进行显微操作等。显微镜主机搭配各种光学组件可以实现各种观察方法:明场、相差、暗场、微分干涉(DIC)、整合调制反差(IMC)等,针对不同的标本,选用适合的观察方法才能得到很好的图像。
明场观察
通常所说的明场,指的是由显微镜光源的照明光经过聚光镜汇聚照射到标本上,被标本吸收后,剩余的光进入物镜,然后通过目镜被人眼看到或者被通过C接口被摄像头拍到。照明光路采用科勒照明或临界点照明。
血涂片、革兰氏染色的细菌涂片、染色的病理切片、植物的切片、骨磨片等都采用明场方式观察。这几类标本比较适合用正置显微镜观察,与倒置显微镜相比,正置显微镜的聚光镜可以离标本很近,数值孔径比较大,所以整体的分辨率要比倒置镜高,看标本更清楚。
明场观察的要求主要是结构清晰、颜色准确,如何保证清晰准确呢?
首先是制片,为了尽可能的看到清晰的结构,我们先注意一下标本制备中要不要封片以及如何封片的问题,因为不同的物镜对标本封片与否的要求是不一样的。
如下图中的三个物镜,参数中的“0.17”表示在该物镜下观察的标本需要用厚度为0.17mm的盖玻片封片;参数“0”表示在该物镜下观察的标本不能用盖玻片封片,适合各种涂片或磨片;参数“-”表示该物镜对封片与否没有要求,封片或不封片的标本都可以观察。

对于需要封片的标本,标本要浸没在封片剂中,再盖上盖玻片,不可以不加封片剂直接盖盖玻片。封片剂的折射率一般与标本接近,尽量减少成像光路中折射率的突兀变化,以保证很好通透性。生物组织的折射率一般在1.3~1.5之间,盖玻片的玻璃折射率为1.52左右,油镜的油折射率为1.518,所以封片剂的折射率一般不超过1.518。
其次是显微镜组件参数,数值孔径(NA)是物镜和聚光镜的固有参数,物镜的数值孔径(NA)越大分辨率越高,看到的标本就越清楚。同样,聚光镜的数值孔径越大分辨率越高。所以选择数值孔径比较大的物镜和聚光镜有助于看清更多的标本细节孔径光阑(Aperture)位于聚光镜上,孔径数值可调,也影响分辨率,孔径数值越大显微镜成像分辨率越高。

注意:物镜和聚光镜的数值孔径越大,其工作距离(或者理解为焦距)越短。孔径光阑数值越大,显微镜成像的对比度越低,景深越小。
另外,照明光源的色温会影响到显色效果。同一个标本,照明色温比较低时,标本中的红色就比较鲜艳,蓝色比较暗;相反色温偏越高时,标本中蓝色就越鲜艳红色越暗。
显微镜常用作明场照明的光源有两种:卤素灯和LED灯。
卤素灯的整体色温比较低,看起来明显偏黄色,一般会在照明光路里加一个日光滤片提高色温,使标本的颜色更均衡。然而卤素灯的色温会随着灯的亮度而变化,灯调节的越亮,色温越高。我们知道在使用显微镜从低倍物镜转换到高倍物镜时,需要调亮照明光来保证目镜观察到的视野亮度一致,这样就会导致色温升高,从而使得高倍镜看到的标本中蓝色结构比低倍镜中更鲜艳,而低倍镜中看到的红色结构更鲜艳。要解决这个色彩偏差,方法有:
基础的显微镜可以配置恒定亮度的物镜组,低倍镜跟高倍镜的亮度一样,这样就不需要调整灯的亮度。
全自动显微镜使用恒定色温转轮,根据不同物镜自动调整卤素灯亮度并自动调节色温转轮,来使照明色温保持恒定。
使用恒定色温的照明光源:LED灯。
LED灯的色温恒定,不会随亮度变化。显微镜明场照明用的LED灯通常色温恒定在5000K,接近太阳光的平均色温。
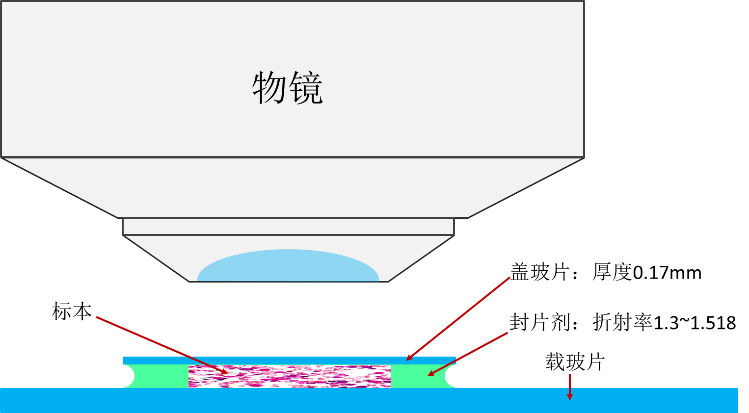
使用显微镜配备的摄像头拍照时,如果发现电脑屏幕上呈现的图像偏色,就需要先做一下白平衡。
颜色的鲜艳程度则可以通过色饱和度调节,饱和度越高,图像色彩越艳丽,饱和度较低时,图像就失去色彩呈现为黑白色。
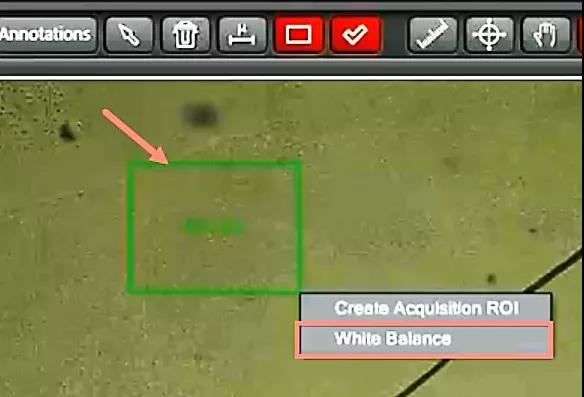
需要注意的是,不必要求屏幕上显示的标本颜色跟目镜里看到的完全一致,因为任何显示器所能显示的颜色都是有限的,如下图所示,在Lab色域图中,舌头形状的区域为人眼所能看到的颜色,专业的显示器执行Adobe RGB标准,所能呈现的颜色为黑色虚线三角形内的区域,一般的显示器执行sRGB标准,能呈现的颜色就更少了。
相差成像
检查培养中的活细胞的生长状态时,常用相差方法观察。因为活细胞一般不染色,细胞比较透明,直接用明场观察的话不容易看清楚,用相差方式可以提高反差(下图),更容易看清细胞状态。
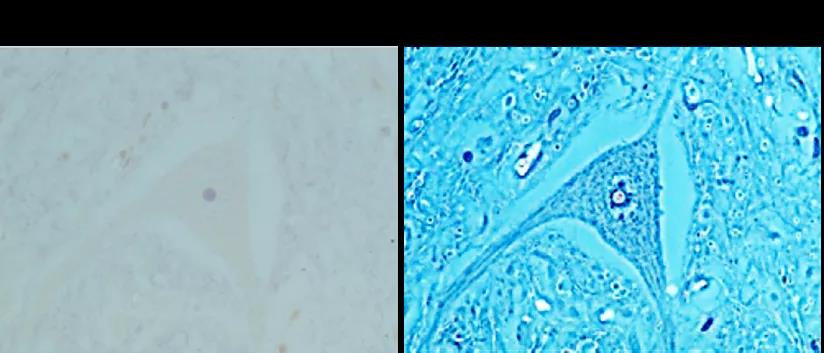
显微镜要实现相差效果需要两个条件:相差物镜和相差环,观察时需要选择相差物镜并将对应的相差环移入光路。相差物镜上会有标志“PH0”、“PH1”、“PH2”等,数字表示对应的相差环型号,另外相差环上也会明确标注对应的物镜倍数,使用相差时一定要保证物镜和相差环正确匹配。

暗场观察
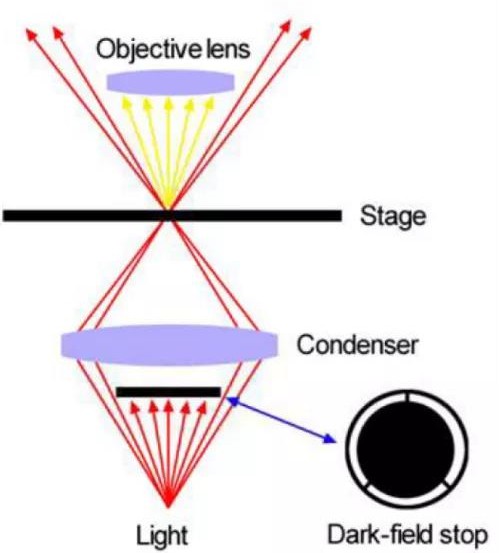
实际是暗场照明法。不直接观察到照明的光线,而观察到的是被物体反射或散射的光线,暗背景,样品闪亮(下图)。适合观察微小水生生物、纤维、毛发、细菌,以及进行尿检等。

暗场观察所需要的特殊附件是暗场环和聚光镜,聚光镜的数值孔径至少比所用物镜大0.2才可以实现较好的暗场效果。
微分干涉(DIC)成像
如果细胞标记了荧光,就不太适合再用相差物镜观察了,因为相差物镜内有相位环,会阻挡部分荧光,此时比较适合的反差增强方法是DIC。DIC可以用高透光的复消色差物镜搭配DIC棱镜和偏光片来实现,拍摄荧光时DIC组件可以从光路中移除,不会对荧光成像产生影响。
DIC呈现出漂亮的3D图像(非真实三维图像),无光晕,分辨率大于相差,适合搭配荧光,但是不适合在塑料器皿中成像。
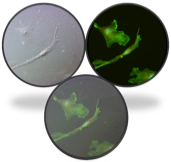
DIC成像时需要在光路中移入4个组件,相对比较复杂,所以一般配在全自动显微镜上,由显微镜自动控制各个组件,以方便使用者操作。并可实现长时间定时拍摄,记录动态过程。
整合调制反差(IMC)成像
显微操作时,需要标本呈现出一定的立体效果,DIC虽然有立体效果,但是用DIC时不能用塑料器皿,而显微操作多数都是在塑料器皿里进行的。整合调制反差(IMC)或者霍夫曼反差(HMC)正好满足这个需求。
IMC或者HMC是一种斜照明效果,一侧的狭缝照明造成阴影,产生立体效果。可用于塑料器皿内标本的显微操作。
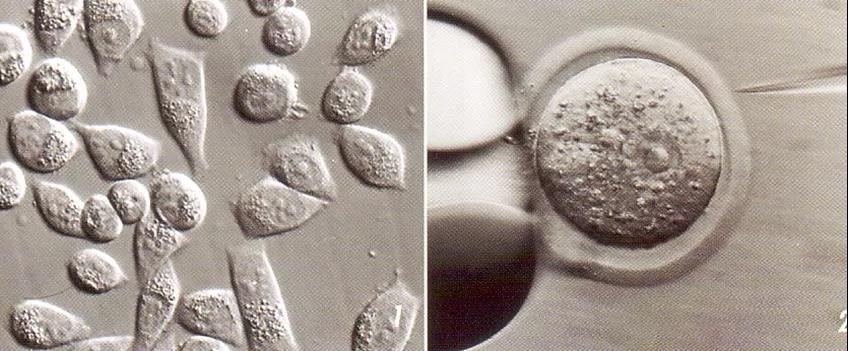
HMC需要专用的物镜搭配聚光镜上的调制器,专用物镜对荧光有一定的阻挡。IMC无需专用物镜,可用普通物镜搭配调制器实现,对荧光成像没有影响。
声明:文章来源于公众号徕卡显微系统,旨在分享若涉及版权问题请电话联系021-33587030